K (Linkkorrektur) |
(Taktik) |
||
| Zeile 1: | Zeile 1: | ||
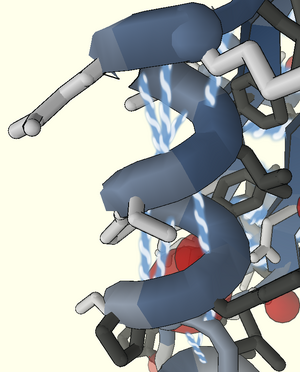
[[Bild:Helix_puzzle150.png | right | 300px | Helix im Farbenblind-Modus]] Die Helix ist eine der drei grundlegenden Strukturen in Foldit. In der idealen Form erscheint eine Helix als schraubenförmige Spirale, bei der alle [[Seitenkette]]n nach außen weisen. Ideale Helices haben [[Wasserstoffbrücke]]n zwischen jeder dritten [[Aminosäuren|Aminosäure]] in der Kette. |
[[Bild:Helix_puzzle150.png | right | 300px | Helix im Farbenblind-Modus]] Die Helix ist eine der drei grundlegenden Strukturen in Foldit. In der idealen Form erscheint eine Helix als schraubenförmige Spirale, bei der alle [[Seitenkette]]n nach außen weisen. Ideale Helices haben [[Wasserstoffbrücke]]n zwischen jeder dritten [[Aminosäuren|Aminosäure]] in der Kette. |
||
| − | Die |
+ | Die Helixstruktur wird angewandt um die wirkliche Proteinstruktur anzuzeigen, die man Alpha-Helix (α-Helix) nennt. Die ideale α-Helix würde je eine Umdrehung (360°) per je 3.6 Aminosäuren aufzeigen. |
| + | |||
| + | Bei mehreren großen Helices in einem Protein liegen diese meist leicht verschoben parallel zueinander angeordnet. Kleinere Helices mit nur einer Drehung liegen dagegen sehr häufig abseits von den anderen Helices und um 70°-80° gekippt. |
||
| + | |||
| + | ==Taktik== |
||
| + | Eine Helix ist bereits eine stabile Struktur, deshalb sind [[Rückgrat|Rückgratveränderungen]] nicht ratsam. <br> |
||
| + | Es ist jedoch möglich, per [[tweak]] die gesamte Struktur zu drehen oder zu strecken. Dies sollte nicht übertrieben werden, kann aber für einen deutlichen Punkteanstieg sorgen, insbesondere wenn durch das Drehen hydrophobe Seitenketten auf die Innenseite und hydrophile Seitenketten nach außen gedreht werden. |
||
| + | |||
| + | Wichtigster Teil für Verbesserung sind die Seitenketten. Helices werden oft auf einer Seite von [[Faltblatt|Faltblättern (sheets)]] umgeben. Durch Neuanordnen einzelner oder mehrerer Seitenketten können diese Strukturen einander angenähert und [[Void]]s geschlossen werden. |
||
Aktuelle Version vom 25. Juni 2009, 08:39 Uhr
Die Helix ist eine der drei grundlegenden Strukturen in Foldit. In der idealen Form erscheint eine Helix als schraubenförmige Spirale, bei der alle Seitenketten nach außen weisen. Ideale Helices haben Wasserstoffbrücken zwischen jeder dritten Aminosäure in der Kette.
Die Helixstruktur wird angewandt um die wirkliche Proteinstruktur anzuzeigen, die man Alpha-Helix (α-Helix) nennt. Die ideale α-Helix würde je eine Umdrehung (360°) per je 3.6 Aminosäuren aufzeigen.
Bei mehreren großen Helices in einem Protein liegen diese meist leicht verschoben parallel zueinander angeordnet. Kleinere Helices mit nur einer Drehung liegen dagegen sehr häufig abseits von den anderen Helices und um 70°-80° gekippt.
Taktik[]
Eine Helix ist bereits eine stabile Struktur, deshalb sind Rückgratveränderungen nicht ratsam.
Es ist jedoch möglich, per tweak die gesamte Struktur zu drehen oder zu strecken. Dies sollte nicht übertrieben werden, kann aber für einen deutlichen Punkteanstieg sorgen, insbesondere wenn durch das Drehen hydrophobe Seitenketten auf die Innenseite und hydrophile Seitenketten nach außen gedreht werden.
Wichtigster Teil für Verbesserung sind die Seitenketten. Helices werden oft auf einer Seite von Faltblättern (sheets) umgeben. Durch Neuanordnen einzelner oder mehrerer Seitenketten können diese Strukturen einander angenähert und Voids geschlossen werden.